Sejtanalitikai kutatócsoport
Kutatócsoport vezető: Dr. Szöllősi János, egyetemi tanár, akadémikus
E-mail: szollo@med.unideb.hu
Weblap
Projektvezető:
Dr. Bacsó Zsolt, habilitált egyetemi docens
LSC laborvezető (Laser-Scanning Cytometry - tárgylemez alapú képalkotó citometria)
A kutatócsoport jelenlegi tagjai:
- Biwott Kipchumba, MSc, PhD hallgató
- Algirmaa Lkhamkhuu, MSc, PhD hallgató
A kutatócsoport korábbi tagjai:
- Bankó Csaba, tudományos segédmunkatárs (témavezető: Dr. Bacsó Zsolt)
- Dr. Gellén Gabriella, PhD hallgató (témavezető: Dr. Bacsó Zsolt)
Kutatási projektek:
1. Koleszterinfüggő epitóp keresése a P-glikoproteinen. Keresztkötéses tömegspektrometria membrán fehérjéken. (Dr. Gellén Gabriella, témavezető Dr. Bacsó Zsolt)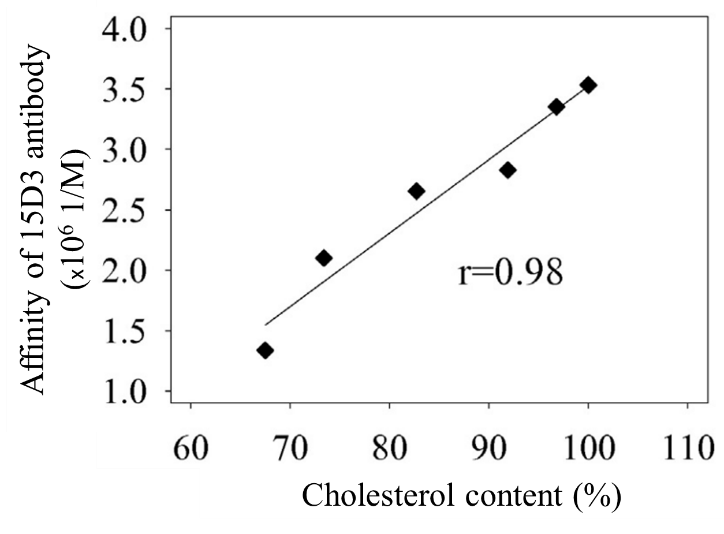
A P-glikoprotein, melyet először a multidrogrezisztencia kialakításáért meghatározóan felelős fehérjeként azonosítottak, a szervezet több más fiziológiás funkciójában is fontos szerepet játszik. Xenobikum transzporterként megtalálható egyes szervek epitheliális vagy endotheliális védelmi rendszerében, ilyenek például a bélhám, véragygát, placenta vagy a herék érrendszere. Érdekes módon, a fehérvérsejteken is jelentős mértékben expresszálódik, mely a gyulladásos folyamatokban betöltött vélhető szerepére utal.
Korábbi munkáinkban megállapítottuk, hogy a P-glikoprotein részben a membránok koleszterin dús doménjeiben lokalizálódig és működése koleszterinfüggést mutat. Azonosítottunk továbbá egy olyan antitestet melynek a P-glikoproteinhez való kötődése koleszterinfüggést mutat.
Ezen fehérje működésének koleszterinfüggő aspektusa feltárhatja a membránfehérjék általános koleszterin érzékenységének a molekuláris hátterét mellyel a szteránvázas vegyületek evolúciós szerepének megértéséhezhez is közelebb kerülünk.
2. Fizikai és kémiai sejtkárosodási mechanizmusok citometriája. (Bankó Csaba, témavezető Dr. Bacsó Zsolt)
Minden sejt válaszol külső fizikai és kémiai behatásokra. Az evolúció során a külső behatások specializált felismerésének a szükségessége vezetett a sejtreceptorok kialakulásához. Az intenzívebb behatások, ugyanakkor sejtkárosítók lehetnek. Az ionizáló sugárzások közvetlen kovalens kötést bontó hatása jól ismert, mely a makromolekulák maradandó sérülésében nyilvánulhat meg. Ugyanakkor kevésbé ismert a fény illetve más elektromágneses, de nem ionizáló sugárzások sejtkárosító képességének hatásmechanizmusa. Ha pl. a sejtek DNS-e törik, ez öröklődő károsodáshoz vezethet. A másik véglet, amikor a sejt citoplazma membránja sérül, és a sejt azonnal elpusztul. A két szélsőség között helyezkednek el azon szintű károsodások, melyek programozott sejtelhaláshoz vezethetnek. Citometriás módszerekkel a külső behatások eredménye jól követhető az egyedi sejtek szintjén. A projektben kíváncsiak vagyunk például arra, hogy a mobil telefonok rádiófrekvenciás sugárzása képes-e genetikai károsodást, azaz DNS kettősszál törést létrehozni, illetve arra, hogy a fény fotodinámiás hatása milyen mechanizmusokkal károsítja a sejteket.
3. Adipocita differenciáció képalkotó citometriás karakterizálása (kollaboráció Dr. Kristóf Endrével, Prof. Dr. Fésüs Lászlóval és Dr. Doan Minhnel)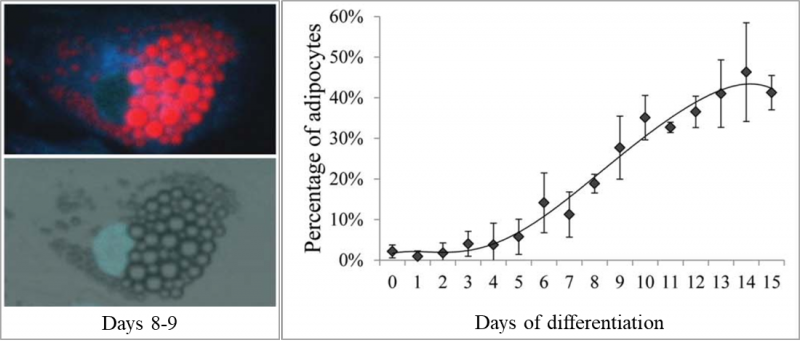
A humán mezenchimális őssejtek zsírsejtekké történő differenciációja fontos terápiás lehetőségeket rejt magában, így lényeges az adipogén differenciáció ex vivo megismerése. A preadipociták morfológiailag jól elkülönülnek a differenciált fehér és a barna zsírsejtektől, ugyanakor a konfluens adipocita sejtkultúrákban a sejtek automatizált mikroszkópos azonosítása komoly kihívást jelent. Munkánk során eljárást dolgoztunk ki a zsírsejtek képalkotó citometriás jellemzésére és az adipogén differenciáció objektív mérésére. További célunk a még hatékonyabb barna, bézs és fehér irányú differenciáció mérése, a differenciált sejtek aktivitásának mikroszkópiás megítélése és a mesterséges intelligencián alapuló automatizált képi karakterizáció kidolgozása.
4. Az ABC transzporterek szerepe a fehérvérsejtek migrációjában. (témavezető Dr. Bacsó Zsolt)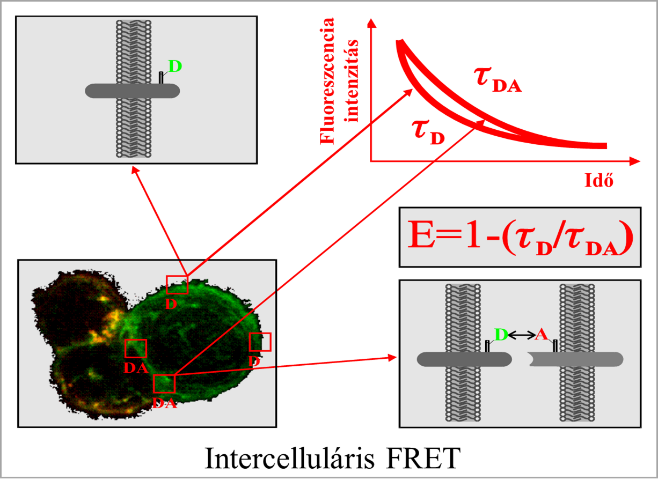
A fehérvérsejtek képesek átjutni az érfalak és nyirokerek endothel rétegén, hogy a szervezet gyulladt szöveti közé jussanak. Bár ennek a transzmigrációnak számos molekuláris játékosát ismerjük, vannak olyan nem-kanonikus komponensek, amelyek kevésbé ismertek. Például, ha gátoljuk néhány multidrog rezisztenciát okozó ABC transzporter működését, ez megakadályozza bizonyos immunsejteknek a nyirokcsomókból való kijutását. Célunk, hogy az általunk bevezetett módszerek segítségével jobban megértsük ennek az érdekes jelenségnek a részleteit, melynek terápiás vonatkozása is várható.
Reprezentatív publikációk
1. Bacso, Z. (2017). Need for winning combinations of modalities in cytometry of stem cells. Cytometry A 91, 312-313.
2. Gutay-Toth, Z, Fenyvesi, F, Barsony, O, Szente, L, Goda, K, Szabo, G, and Bacso, Z. (2016). Cholesterol-dependent conformational changes of P-glycoprotein are detected by the 15D3 monoclonal antibody. Biochim Biophys Acta 1861, 188-195.
3. Doan-Xuan, QM, Sarvari, A.K, Fischer-Posovszky, P, Wabitsch, M, Balajthy, Z, Fesus, L, and Bacso, Z. (2013). High content analysis of differentiation and cell death in human adipocytes. Cytometry A 83, 933-943.
4. Barok M, Isola J, Pályi-Krekk Z, Nagy P, Juhász I, Vereb G, Kauraniemi P, Kapanen A, Tanner M, Vereb G, Szöllősi J. (2007) "Trastuzumab causes antibody-dependent cellular cytotoxicity-mediated growth inhibition of submacroscopic JIMT-1 breast cancer xenografts despite intrinsic drug resistance. "Mol Cancer Ther. 6(7):2065-2072.
5. Bacso, Z, Nagy, H, Goda, K, Bene, L, Fenyvesi, F, Matko, J, and Szabo, G. (2004). Raft and cytoskeleton associations of an ABC transporter: P-glycoprotein. Cytometry A 61, 105-116.
6. Bacso, Z, Bene, L, Damjanovich, L, and Damjanovich, S. (2002). INF-gamma rearranges membrane topography of MHC-I and ICAM-1 in colon carcinoma cells. Biochem Biophys Res Commun 290, 635-640.
7. Bacso, Z, Everson, RB, and Eliason, JF. (2000). The DNA of annexin V-binding apoptotic cells is highly fragmented. Cancer Res 60, 4623-4628.
8. Bacso, Z, Bene, L, Bodnar, A, Matko, J, and Damjanovich, S. (1996). A photobleaching energy transfer analysis of CD8/MHC-I and LFA-1/ICAM-1 interactions in CTL-target cell conjugates. Immunol Lett 54, 151-156.
Legutóbbi publikációk
1. Saghy, T, Koroskenyi, K, Hegedus, K, Antal, M, Banko, C, Bacso, Z, Papp, A, Stienstra, R, and Szondy, Z. (2019). Loss of transglutaminase 2 sensitizes for diet-induced obesity-related inflammation and insulin resistance due to enhanced macrophage c-Src signaling. Cell death & disease 10, 439.
2. Nagy, M, Racz, D, Nagy, ZL, Feher, PP, Kovacs, SL, Banko, C, Bacso, Z, Kiss, A, Zsuga, M, and Keki, S. (2019). Amino-isocyanoacridines: Novel, Tunable Solvatochromic Fluorophores as Physiological pH Probes. Scientific reports 9, 8250.
3. Kristof, E, Klusoczki, A, Veress, R, Shaw, A, Combi, Z.S, Varga, K, Gyory, F, Balajthy, Z, Bai, P, Bacso, Z, et al. (2019). Interleukin-6 released from differentiating human beige adipocytes improves browning. Experimental cell research 377, 47-55.
4. Klusoczki, A, Vereb, Z, Vamos, A, Fischer-Posovszky, P, Wabitsch, M, Bacso, Z, Fesus, L, and Kristof, E. (2019). Differentiating SGBS adipocytes respond to PPARgamma stimulation, irisin and BMP7 by functional browning and beige characteristics. Scientific reports 9, 5823.
5. Budai, Z, Ujlaky-Nagy, L, Kis, GN, Antal, M, Banko, C, Bacso, Z, Szondy, Z, and Sarang, Z. (2019). Macrophages engulf apoptotic and primary necrotic thymocytes through similar phosphatidylserine-dependent mechanisms. FEBS open bio 9, 446-456.
6. Szendi-Szatmári T, Szabó Á, Szöllősi J, Nagy P (2019) Reducing the Detrimental Effects of Saturation Phenomena in FRET Microscopy. Anal Chem 91:6378-6382.
7. Costea T, Nagy P, Ganea C, Szöllősi J, Mocanu MM. (2019) Molecular Mechanisms and Bioavailability of Polyphenols in Prostate Cancer. Int J Mol Sci. 20:1062.
8. Czimmerer, Z, Daniel, B, Horvath, A, Ruckerl, D, Nagy, G, Kiss, M, Peloquin, M, Budai, MM, Cuaranta-Monroy, I, Simandi, Z, et al. (2018). The Transcription Factor STAT6 Mediates Direct Repression of Inflammatory Enhancers and Limits Activation of Alternatively Polarized Macrophages. Immunity 48, 75-90 e76.